研究分野
脳血管障害グループ
脳血管障害グループでは主にくも膜下出血の原因となる脳動脈瘤、脳梗塞の原因である脳虚血について研究を行っています。具体的な研究内容について説明します。
脳動脈瘤の流体力学的解析
数値流体力学 (CFD: computational flow dynamics) 解析は理工学分野で確立された技術ですが、近年様々な分野で応用されています。
脳神経外科分野においても脳動脈瘤の発生、成長、破裂のメカニズムの解明や、動脈硬化、治療後の再発予測が期待されています。
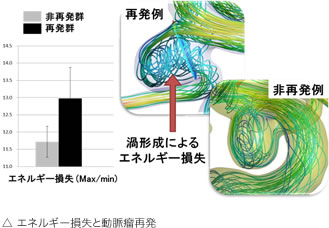
我々は血管内コイル塞栓術後の再発に着目し、研究を行っています。 血管内コイル塞栓術は低侵襲であり、近年脳動脈瘤治療において広く行われている治療法ですが、開頭クリッピングと比較して再発率が高いという問題点があります。そこでコイル塞栓術後の再発を予測できれば、術前に治療戦略を変える事ができ、脳動脈瘤に対する治療方法を選ぶ上で有用と考えました。
我々は様々な流体力学的因子と再発との関連を調べた結果、pressure difference (コイル面における圧力) が、再発と強く関わっている事がわかりました。pressure differenceは術前検査のデータから作成した血管モデルで測定可能であり、非常に有用な因子です。
Nambu I, et al., Neurosurgery (2019) 84: 607-615
現在は症例数を増やし、異なる血管モデルで検討するなど、更なる検証を行っています。この因子の真実性が高まれば、臨床応用が可能であり、患者様に有益な情報が得られると考えています。
遅発性神経細胞死の現象解明
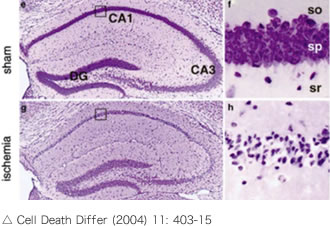 遅発性神経細胞死とは、右の図のように、海馬のCA1領域において、虚血後2-3日で神経細胞の減少と萎縮(アポトーシス)が生じる現象です。我々は、esRAGEというたんぱく質を血管内に投与することで、遅発性神経細胞死を防ぐことができるのではないかと考え実験を行いました。
遅発性神経細胞死とは、右の図のように、海馬のCA1領域において、虚血後2-3日で神経細胞の減少と萎縮(アポトーシス)が生じる現象です。我々は、esRAGEというたんぱく質を血管内に投与することで、遅発性神経細胞死を防ぐことができるのではないかと考え実験を行いました。
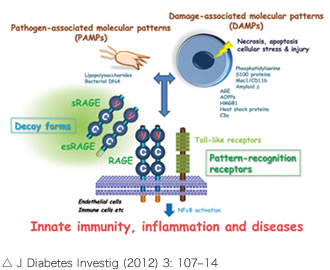
RAGEには大きく分けて膜型RAGEと可溶型RAGE(esRAGEなど)に分かれます。膜型RAGEは下の図のように1回膜貫通型タンパクでV,C,Cの3つのドメインを持ちVドメインにリガンドが結合することにより虚血時の炎症シグナル伝達に関わっています。一方esRAGEは膜型RAGEのスプライスバリアントで競合受容体として膜型RAGEにリガンドが結合するのをブロックしています。
 遅発性神経細胞死を生じさせるモデルとしてBCCAOモデルというものが一般的に用いられています。BCCAOモデルとは、マウスの両側の総頸動脈を20分間結紮し、再灌流させることにより海馬のCA1領域に遅発性神経細胞死を生じさせるモデルです。今回我々もそのモデルを用いて、esRAGEを静脈内投与したモデルと投与していないモデルで遅発性神経細胞死がどのように変わってくるのかということについて実験を行いました。海馬CA1領域の、神経細胞数計測やアポトーシスを検出する染色(カスパーゼⅢ染色など)を行うことでesRAGEの遅発性神経細胞死に対する効果を研究しています。
遅発性神経細胞死を生じさせるモデルとしてBCCAOモデルというものが一般的に用いられています。BCCAOモデルとは、マウスの両側の総頸動脈を20分間結紮し、再灌流させることにより海馬のCA1領域に遅発性神経細胞死を生じさせるモデルです。今回我々もそのモデルを用いて、esRAGEを静脈内投与したモデルと投与していないモデルで遅発性神経細胞死がどのように変わってくるのかということについて実験を行いました。海馬CA1領域の、神経細胞数計測やアポトーシスを検出する染色(カスパーゼⅢ染色など)を行うことでesRAGEの遅発性神経細胞死に対する効果を研究しています。
脳虚血と神経保護の研究
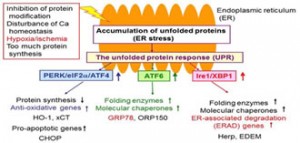 小胞体は、蛋白質・脂質の生合成、Ca恒常性の維持を司る細胞内小器官ですが、エネルギー枯渇、Ca異常、蛋白質の合成過多など、細胞内環境の悪化は小胞体への変性蛋白質の蓄積をもたらし、いわゆる小胞体ストレスを引き起こします。これに対し細胞は、小胞体膜を起源とするストレス応答、unfolded protein response (UPR)を活性化し、小胞体内環境を改善することで細胞内恒常性を維持しています。
小胞体は、蛋白質・脂質の生合成、Ca恒常性の維持を司る細胞内小器官ですが、エネルギー枯渇、Ca異常、蛋白質の合成過多など、細胞内環境の悪化は小胞体への変性蛋白質の蓄積をもたらし、いわゆる小胞体ストレスを引き起こします。これに対し細胞は、小胞体膜を起源とするストレス応答、unfolded protein response (UPR)を活性化し、小胞体内環境を改善することで細胞内恒常性を維持しています。
脳虚血において小胞体ストレスが惹起され、UPRの活性化が神経保護に繋がること等が報告されていますがそれらの詳細なメカニズムについては不明な点が多いとされています。私たちは、脳虚血における小胞体ストレスのメカニズム解明のため主要転写因子ATF6αをノックアウトしたマウスを用いて解析を行いました。
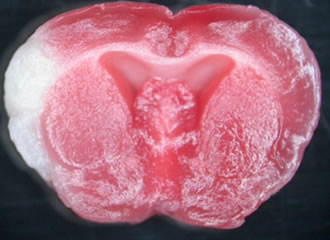 マウスの永久的中大脳動脈閉塞(MCAO)モデルおよび培養アストロサイトを用いた検討を行い、特に、小胞体ストレス応答における主要転写因子ATF6αの重要性について解明を試みました。MCAOモデルはマウスの側頭骨部を開頭し、直下に見える中大脳動脈を凝固切断する方法を用いています。
マウスの永久的中大脳動脈閉塞(MCAO)モデルおよび培養アストロサイトを用いた検討を行い、特に、小胞体ストレス応答における主要転写因子ATF6αの重要性について解明を試みました。MCAOモデルはマウスの側頭骨部を開頭し、直下に見える中大脳動脈を凝固切断する方法を用いています。
野生型マウス、及びAtf6αノックアウトマウスを用いてMCAOを作製すると、Atf6αノックアウトマウスで梗塞体積および神経細胞死の増加が認められました。更に、同マウスではアストロサイトの活性化・グリア瘢痕形成が減弱し、非梗塞巣への組織障害の拡大が確認されました。
またAtf6αを欠損したアストロサイトではグリア瘢痕形成に関連するリン酸化STAT3(p-STAT3)およびGFAPの発現が減弱していることが明らかになりました。
以上の結果より、ATF6αは脳虚血下で起こるアストロサイトの活性化、グリア瘢痕形成を介して、神経保護において重要な役割を担っていることが示されました。
Yoshikawa A, et al., J Neurochem (2015) 132: 342-53
ATF6βと全脳虚血
前述のように、転写因子ATF6αが、脳虚血下で起こるアストロサイトの活性化、グリア瘢痕形成を介して、神経保護において重要な役割を担っていることが分かりました。一方で、ATF6の別のサブタイプであるATF6βの脳虚血下における役割に関しては明らかなになっていません。そこで、我々はATF6βが全脳虚血下での神経保護への関与について解析を行っています。
全脳虚血は、麻酔下に頚部正中を切開して両側総頚動脈を露出後、マイクロクリップで一時遮断して、Bilateral common carotid arteries occlusion (BCCAO) モデルを作成しています。モデル作成後、海馬CA1領域における神経細胞死や、グリア細胞の変化などの評価を行っています。

